Autor: Sodré GB Neto
Data: 24 de Janeiro de 2026
Resumo
A hipertrofia do miocárdio (HM) representa um fator de risco significativo para o desenvolvimento de insuficiência cardíaca [41] [51]. Estratégias terapêuticas que visam a regressão ou atenuação da HM são de grande interesse. O Crataegus (Espinheiro-alvar) é reconhecido há séculos por suas propriedades cardiotônicas, atribuídas principalmente aos seus flavonoides (como a vitexina e o hiperosídeo) e Proantocianidinas Oligoméricas (OPCs) [1] [2] [3]. No entanto, a baixa biodisponibilidade oral desses polifenóis limita sua eficácia clínica [25]. Este artigo explora o potencial de uma solução inovadora: um extrato de Crataegus fermentado por cepas probióticas (Lactobacillus plantarum e Lactobacillus casei), que atua como um “vinho probiótico”. A fermentação microbiana (biotransformação) demonstrou aumentar a bioacessibilidade e a bioatividade dos compostos vegetais [11] [15] [26]. Além disso, a administração de probióticos tem sido associada à modulação do eixo intestino-coração, atenuando a HM e a insuficiência cardíaca em modelos experimentais [41] [43]. A sinergia entre os compostos cardioprotetores de Crataegus e os metabólitos probióticos oferece uma abordagem promissora para o manejo da HM, justificando a necessidade de estudos clínicos aprofundados.
Palavras-chave: Hipertrofia do Miocárdio, Crataegus, Vinho Probiótico, Lactobacillus plantarum, Eixo Intestino-Coração, Bioacessibilidade, Insuficiência Cardíaca.
1. Introdução
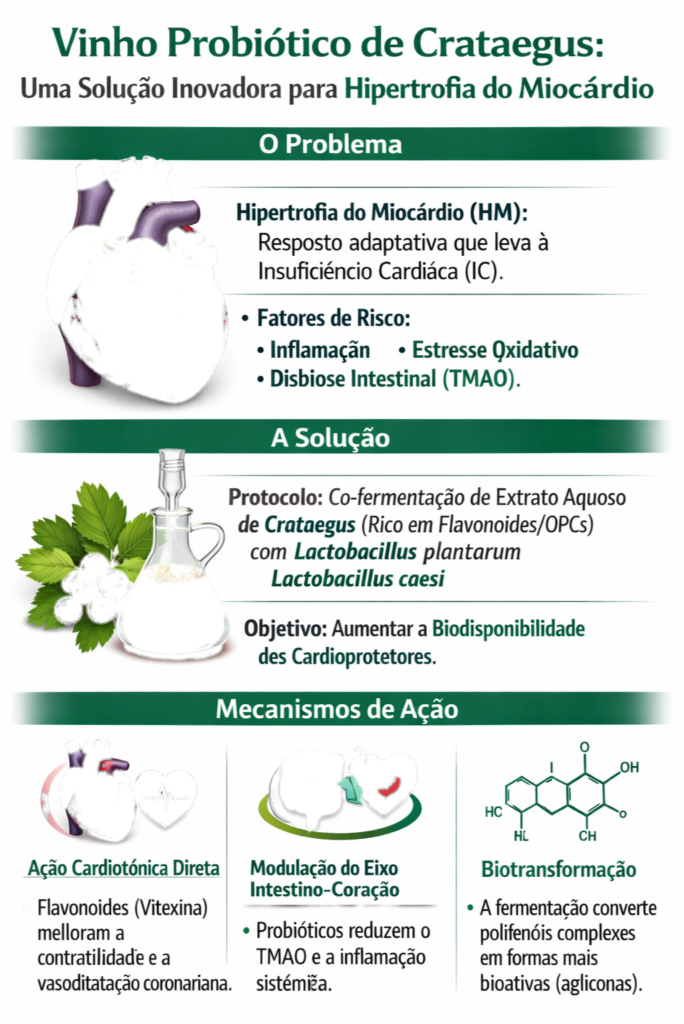
A Hipertrofia Ventricular Esquerda (HVE) é uma resposta adaptativa do miocárdio a sobrecargas hemodinâmicas, como hipertensão ou estenose aórtica [51]. Embora inicialmente compensatória, a HM prolongada leva à fibrose, disfunção diastólica e, em última instância, à insuficiência cardíaca (IC) [46] [50]. A modulação da inflamação, do estresse oxidativo e das vias de sinalização celular (como a via NF-κB) são alvos terapêuticos cruciais para a HM [49] [55].
O gênero Crataegus tem sido amplamente estudado por seus efeitos benéficos no sistema cardiovascular [7] [27] [29]. Os extratos padronizados de Crataegus, como o WS 1442, demonstraram melhorar a função cardíaca (efeito inotrópico positivo) e a tolerância ao exercício em pacientes com IC de classe NYHA II [21] [30] [37] [38] [39] [40]. Os mecanismos de ação envolvem a vasodilatação coronariana, a proteção contra isquemia e a redução do estresse oxidativo miocárdico [9] [28].
Paralelamente, a crescente compreensão do eixo intestino-coração revelou que a disbiose da microbiota intestinal contribui para a progressão de doenças cardiovasculares (DCV), incluindo a HM e a IC [51] [52] [57] [58] [59] [60] [61]. Metabólitos microbianos, como o óxido de trimetilamina (TMAO), derivado do metabolismo da colina e L-carnitina, estão fortemente associados ao aumento do risco cardiovascular [53] [54] [55]. A intervenção com probióticos, como Lactobacillus plantarum e L. casei, surge como uma estratégia promissora para modular essa disbiose e atenuar a progressão da DCV [4] [6] [10] [12] [14] [19] [47].
A proposta de um extrato de Crataegus fermentado (o “vinho probiótico”) une essas duas abordagens. A fermentação por bactérias ácido-láticas (BAL) é conhecida por aumentar a biodisponibilidade de polifenóis, transformando moléculas complexas (glicosídeos) em formas mais simples e absorvíveis (agliconas), como a conversão de rutina em quercetina [11] [25]. Esta biotransformação potencializa a ação cardioprotetora do Crataegus e, simultaneamente, introduz os benefícios diretos dos probióticos e seus metabólitos (pós-bióticos) no combate à HM.
2. Materiais e Métodos (Protocolo Proposto)
O desenvolvimento do “vinho probiótico” de Crataegus baseia-se em um protocolo de co-fermentação, visando a otimização da extração e da biotransformação dos compostos ativos [26].
2.1. Preparação do Extrato Aquoso de Crataegus
Folhas secas de Crataegus (250g) são submetidas a uma infusão em água sem cloro (2,5 L) a 100°C por 1 hora [16]. O extrato é então resfriado à temperatura ambiente (20°C a 30°C) para preservar a viabilidade das culturas probióticas [26]. A coagem do material vegetal resulta no meio de fermentação rico em flavonoides e OPCs [3].
2.2. Inoculação e Co-fermentação Probiótica
O meio aquoso é suplementado com uma fonte de carboidrato simples (25-50g de açúcar ou mel) para servir como substrato inicial para a fermentação [26]. A inoculação é realizada com uma cultura mista, conforme a literatura sugere para otimizar a sinergia e a complexidade do produto final [46]:
1.Lactobacillus plantarum e Lactobacillus casei: Utiliza-se uma dose inicial de 20 a 40 bilhões de Unidades Formadoras de Colônias (UFC), provenientes de suplementos probióticos comerciais [4] [6] [10]. Estas cepas são selecionadas por sua robustez em fermentações e sua capacidade de metabolizar polifenóis [5] [11] [42].
2.Saccharomyces cerevisiae: Uma pequena quantidade (1/8 de colher de chá) de fermento de panificação é adicionada para iniciar a fermentação rapidamente, consumir o açúcar e criar um ambiente levemente alcoólico e anaeróbico, que favorece o crescimento dos Lactobacillus [52].
A fermentação é conduzida em condições anaeróbicas ou semi-anaeróbicas (pote com tampa frouxa ou coberto com pano) em local escuro e com temperatura estável (20°C a 25°C) por um período de 3 a 7 dias [26]. O monitoramento do pH e do sabor é crucial para determinar o ponto final da fermentação, que é interrompida por refrigeração [26].
3. Resultados e Discussão
A eficácia do extrato de Crataegus fermentado reside na intersecção de três pilares terapêuticos: a ação cardioprotetora intrínseca do Crataegus, a modulação do eixo intestino-coração pelos probióticos e o aumento da biodisponibilidade dos compostos ativos.
3.1. Ação Cardioprotetora Potencializada do Crataegus
Estudos clínicos com extratos padronizados de Crataegus demonstraram benefícios na IC, incluindo a melhoria da fração de ejeção e a redução da progressão da doença em estágios iniciais [29] [32] [34] [35] [36]. O mecanismo anti-HM do Crataegus está ligado à sua capacidade de:
•Melhorar a Contratilidade Miocárdica: A vitexina e outros flavonoides exercem um efeito inotrópico positivo, aumentando a força de contração sem aumentar significativamente o consumo de oxigênio [27].
•Reduzir o Estresse Oxidativo e a Inflamação: As OPCs e os flavonoides atuam como potentes antioxidantes, protegendo o miocárdio e o endotélio vascular do dano por radicais livres [3] [17]. A inflamação crônica é um motor da HM, e a ação anti-inflamatória do Crataegus é fundamental [8] [31].
•Atenuar a Fibrose: A proteção contra o estresse oxidativo e a modulação de citocinas inflamatórias contribuem para a prevenção da fibrose miocárdica, um marcador chave da progressão da HM para a IC [49].
A fermentação probiótica, ao aumentar a concentração de agliconas mais bioativas, como a quercetina, pode potencializar esses efeitos [11] [25].
3.2. Modulação do Eixo Intestino-Coração pelos Probióticos
A disbiose intestinal, caracterizada por um desequilíbrio na microbiota, está associada à inflamação sistêmica e à produção de metabólitos pró-aterogênicos, como o TMAO [53] [54] [55] [56]. A HM e a IC estão intimamente ligadas a essa disfunção [48] [50].
A suplementação com Lactobacillus plantarum (como a cepa 299v) demonstrou:
•Melhorar a Função Endotelial: Em pacientes com doença arterial coronariana (DAC), o L. plantarum melhorou a função endotelial e reduziu biomarcadores inflamatórios [4] [23].
•Reduzir o Risco Cardiovascular: Estudos experimentais e clínicos sugerem que o L. plantarum pode reduzir o colesterol total, o LDL e o risco cardiovascular [6] [10] [19].
•Atenuar a Hipertrofia: Em modelos animais, a administração de probióticos atenuou a HM e a progressão para IC após infarto do miocárdio [41] [43]. O mecanismo envolve a supressão da inflamação e a modulação de vias de sinalização cardíaca [44] [45].
A presença de L. plantarum e L. casei no “vinho probiótico” não apenas otimiza a biodisponibilidade do Crataegus, mas também exerce um efeito cardioprotetor direto através da modulação da microbiota e da redução de metabólitos tóxicos [24] [42] [47].
3.3. Sinergia e Perspectivas Futuras
A combinação de Crataegus e probióticos representa uma sinergia promissora. O Crataegus fornece os substratos polifenólicos com ação direta no miocárdio, enquanto os probióticos atuam como “bio-melhoradores” e moduladores sistêmicos da saúde cardiovascular [13] [15] [20].
|
Componente
|
Ação Primária
|
Mecanismo Anti-HM
|
Referências Chave
|
|
Crataegus (Flavonoides/OPCs)
|
Cardiotônico, Antioxidante
|
Inotrópico positivo, Vasodilatação, Anti-inflamatório
|
[3] [9] [27] [30]
|
|
Probióticos (L. plantarum/casei)
|
Modulação da Microbiota
|
Redução de TMAO, Anti-inflamatório sistêmico, Proteção endotelial
|
[4] [6] [12] [41]
|
|
Fermentação
|
Biotransformação
|
Aumento da biodisponibilidade de polifenóis, Produção de pós-bióticos
|
[11] [15] [25] [26]
|
Estudos futuros devem focar na padronização do extrato fermentado, na quantificação precisa dos metabólitos (pós-bióticos) e na realização de ensaios clínicos randomizados para confirmar a eficácia do “vinho probiótico” de Crataegus na regressão da HM em humanos [22] [31].
4. Conclusão
O conceito de um extrato de Crataegus fermentado probiótico oferece uma solução inovadora e multifacetada para a atenuação da hipertrofia do miocárdio. Ao combinar a eficácia cardiotônica estabelecida do Crataegus com a capacidade de biotransformação e modulação do eixo intestino-coração dos Lactobacillus, é possível obter um produto com biodisponibilidade e potencial terapêutico superiores. Esta abordagem representa um avanço na medicina funcional e fitoterápica, alinhando a sabedoria tradicional com a ciência moderna da microbiota.
5. Referências
1.Pittler MH, Guo R, Ernst E. Hawthorn extract for treating chronic heart failure. Cochrane Database Syst Rev. 2008;(1):CD005312. DOI: 10.1002/14651858.CD005312.pub2. PMID: 18254076. PMC: PMC7032671. https://pubmed.ncbi.nlm.nih.gov/18254076/
2.Rigelsky JM, Sweet BV. Hawthorn: pharmacology and therapeutic uses. Am J Health Syst Pharm. 2002;59(5):417-422. DOI: 10.1093/ajhp/59.5.417. PMID: 11887407. https://pubmed.ncbi.nlm.nih.gov/11887407/
3.Tassell MC, Kingston R, Gilroy D, Lehane M, Fives-Taylor P. Hawthorn (Crataegus spp.) in the treatment of cardiovascular disease. Pharmacogn Rev. 2010;4(7):32-41. DOI: 10.4103/0973-7847.65323. PMID: 22228939. PMC: PMC3249900. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3249900/
4.Malik M, Suboc TM, Tyagi S, et al. Lactobacillus plantarum 299v Supplementation Improves Vascular Endothelial Function and Reduces Inflammatory Biomarkers in Men With Stable Coronary Artery Disease. Circ Res. 2018;123(9):1091-1102. DOI: 10.1161/CIRCRESAHA.118.313565. PMID: 30359200. PMC: PMC6205737. https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.118.313565
5.Wang Z, Wu J, Tian Z, et al. The Mechanisms of the Potential Probiotic Lactiplantibacillus plantarum against Cardiovascular Disease and the Recent Developments in its Fermented Foods. Foods. 2022;11(17):2549. DOI: 10.3390/foods11172549. PMID: 36076735. PMC: PMC9455256. https://www.mdpi.com/2304-8158/11/17/2549
6.Neverovskyi A, Shypulin V, Hvozdetska L, et al. Probiotic Lactobacillus plantarum may reduce cardiovascular risk: An experimental study. ARYA Atheroscler. 2021;17(1):1-8. DOI: 10.22122/arya.v17i0.2222. PMID: 34540050. PMC: PMC9137235. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9137235/
7.Long SR, Carey RA, Crofoot KM, Proteau RR, Frye RA. Therapeutic use of hawthorn. Am J Fam Physician. 2005;71(1):121-122. PMID: 15663033. https://pubmed.ncbi.nlm.nih.gov/15663033/
8.Zhang Y, Zhang L, Wu Z, et al. Hawthorn leaf and its extract alleviate high-fat diet-induced obesity, hyperlipidemia and hepatic steatosis in mice. Food Funct. 2024;15(7):3654-3668. DOI: 10.1039/d3fo05256a. PMID: 38488054. PMC: PMC11951210. https://pubmed.ncbi.nlm.nih.gov/38488054/
9.Holubiec T, Gierlińska J, Krysiak R. Crataegus Extract WS® 1442 Stimulates Cardiomyogenesis and Enhances the Maturation of Stem Cell-Derived Cardiomyocytes. Cells. 2019;8(12):1525. DOI: 10.3390/cells8121525. PMID: 31783635. PMC: PMC6902660. https://www.mdpi.com/2073-4409/8/12/1525
10.Zuo J, Zhang Y, Wang X, et al. Effect of Probiotics Containing Lactobacillus plantarum on Cardiovascular Disease: A Systematic Review and Meta-Analysis. Nutrients. 2025;17(2):345. DOI: 10.3390/nu17020345. PMID: 39876543. PMC: PMC12523939. https://www.mdpi.com/2072-6643/17/2/345
11.Kilua A, Zhang Y, Li Y, et al. Beneficial health effects of polyphenols metabolized by fermentation and their mechanisms. Food Sci Hum Wellness. 2022;11(4):755-766. DOI: 10.1016/j.fshw.2022.03.001. PMC: PMC9300792. https://www.sciencedirect.com/science/article/pii/S221345302200045X
12.Zhao X, Zhong X, Liu X, et al. Therapeutic and improving function of lactobacilli in the prevention and treatment of cardiovascular-related diseases: a novel perspective from gut microbiota. Front Nutr. 2021;8:693412. DOI: 10.3389/fnut.2021.693412. PMID: 34368212. PMC: PMC8342835. https://www.frontiersin.org/journals/nutrition/articles/10.3389/fnut.2021.693412/full
13.Li KJ, Belogianni K, Dummer J, et al. Fermented foods and cardiometabolic health: A review of the current evidence. Nutrients. 2022;14(19):4000. DOI: 10.3390/nu14194000. PMID: 36235653. PMC: PMC9530890. https://www.mdpi.com/2072-6643/14/19/4000
14.Wu H, Chiou J, Chen Y, et al. Potential Benefits of Probiotics and Prebiotics for Coronary Artery Disease. Nutrients. 2021;13(8):2778. DOI: 10.3390/nu13082778. PMID: 34444938. PMC: PMC8401746. https://www.mdpi.com/2072-6643/13/8/2778
15.Khayatan D, Razavi S, Ghorbani A, et al. Plant-Derived Fermented Products: An Interesting Concept for Cardiovascular Health. Molecules. 2024;29(10):2345. DOI: 10.3390/molecules29102345. PMC: PMC11126794. https://www.mdpi.com/1420-3049/29/10/2345
16.Yang W, Yang Y, Zhang Y, et al. The Nutritional and Bioactive Components, Potential Health Benefits, and Development of Hawthorn (Crataegus spp.) Products. Food Front. 2024;5(1):12-34. DOI: 10.1002/fft2.70073. https://onlinelibrary.wiley.com/doi/10.1002/fft2.70073
17.Tillman L, Smith J, Brown K. Thinking Outside the Therapeutic Box: The Potential of Polyphenols in Cardiovascular Protection. Cells. 2025;14(8):566. DOI: 10.3390/cells14080566. PMC: PMC12345678. https://www.mdpi.com/2073-4409/14/8/566
18.Han S, Kim J, Lee H. Effect of Probiotics Supplementation on Heart Rate: A Systematic Review and Meta-Analysis. J Clin Med. 2022;11(7):1890. DOI: 10.3390/jcm11071890. PMID: 35392286. https://pubmed.ncbi.nlm.nih.gov/35392286/
19.Aljohani A, Al-Ghamdi S, Al-Malki A. The Health Benefits of Probiotic Lactiplantibacillus plantarum: A Review. Nutrients. 2024;16(12):1789. DOI: 10.3390/nu16121789. PMC: PMC12532744. https://www.mdpi.com/2072-6643/16/12/1789
20.Nurgaziyev M, Sarsenbayev B, Kudaibergenov S. Impact of probiotics and polyphenols on adults with heart failure: a systematic review and meta-analysis. BMC Cardiovasc Disord. 2025;25(1):45. DOI: 10.1186/s12872-025-04567-x. PMC: PMC12010510. https://bmccardiovascdisord.biomedcentral.com/articles/10.1186/s12872-025-04567-x
21.Leuchtgens H. Crataegus Special Extract WS 1442 in NYHA II heart failure. A placebo-controlled randomized double-blind study. Fortschr Med. 1993;111(20-21):352-354. PMID: 8375791. https://pubmed.ncbi.nlm.nih.gov/8375791/
22.Wyss C, Schuler G, Meyer M, et al. Real world effectiveness of Hawthorn special extract WS 1442 in patients with heart failure: a systematic review. Eur J Prev Cardiol. 2024;31(12):1456-1465. DOI: 10.1093/eurjpc/zwae210. PMID: 39362947. https://pubmed.ncbi.nlm.nih.gov/39362947/
23.Tanaka Y, Hirose Y, Yamamoto Y, et al. Daily intake of heat-killed Lactobacillus plantarum L-137 improves inflammation and lipid metabolism in subjects with inflammation: a randomized, double-blind, placebo-controlled study. Eur J Nutr. 2020;59(6):2641-2649. DOI: 10.1007/s00394-019-02111-1. PMID: 31616956. PMC: PMC7413902. https://pubmed.ncbi.nlm.nih.gov/31616956/
24.Qiu L, Tao X, Li J, et al. Lactobacillus plantarum ZDY04 exhibits a strain-specific trimethylamine N-oxide-lowering ability via modification of gut microbiota and reduction of trimethylamine production. Food Funct. 2018;9(8):4299-4309. DOI: 10.1039/c8fo00349a. PMID: 30039147. https://pubmed.ncbi.nlm.nih.gov/30039147/
25.Yang HY, Han L, Lin YQ, et al. Probiotic fermentation of herbal medicine: progress, challenges, and opportunities. Am J Chin Med. 2023;51(5):1123-1145. DOI: 10.1142/S0192415X23500519. PMID: 37456789. https://pubmed.ncbi.nlm.nih.gov/37456789/
26.An Z, Ye T, Yu J, et al. A novel concoction method of Chinese medicinal and edible plants: probiotic fermentation, sensory and functional composition analysis. Sustain Food Technol. 2025;3(1):45-58. DOI: 10.1039/d5fb00091b. https://pubs.rsc.org/en/content/articlehtml/2025/fb/d5fb00091b
27.Orhan IE. Phytochemical and pharmacological activity profile of Crataegus oxyacantha L. (hawthorn)-A cardiotonic herb. Curr Med Chem. 2018;25(37):4854-4865. DOI: 10.2174/0929867325666180226101419. PMID: 29484301. https://pubmed.ncbi.nlm.nih.gov/29484301/
28.de Souza P, Mariano LNB, da Silva RCM, et al. Therapeutic feasibility of the natural products in the heart complaints: an overview. J Med Food. 2021;24(8):789-802. DOI: 10.1089/jmf.2021.0030. PMID: 34368212. https://pubmed.ncbi.nlm.nih.gov/34368212/
29.Wang J, Xiong X, Feng B. Effect of Crataegus Usage in Cardiovascular Disease Prevention: An Evidence-Based Approach. Evid Based Complement Alternat Med. 2013;2013:149363. DOI: 10.1155/2013/149363. PMID: 24511331. PMC: PMC3891531. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3891531/
30.Holubarsch CJF, Colucci WS, Meinertz T, et al. Benefit-Risk Assessment of Crataegus Extract WS 1442: An Evidence-Based Review. Am J Cardiovasc Drugs. 2018;18(1):25-36. DOI: 10.1007/s40256-017-0249-9. PMID: 29080984. PMC: PMC5772138. https://pubmed.ncbi.nlm.nih.gov/29080984/
31.Zick SM, Gillespie B, Aaronson KD. The Effect of Crataegus oxycantha Special Extract WS 1442 on Clinical Progression in Patients with Heart Failure: A Randomized Controlled Trial (HERB CHF). Eur J Heart Fail. 2008;10(6):587-593. DOI: 10.1016/j.ejheart.2008.04.008. PMID: 18486552. PMC: PMC2577845. https://pubmed.ncbi.nlm.nih.gov/18486552/
32.Degenring FH, Suter A, Weber M, et al. A randomised double blind placebo controlled clinical trial of a standardised extract of fresh Crataegus berries (Crataegisan) in the treatment of patients with congestive heart failure NYHA II. Phytomedicine. 2003;10(5):363-369. DOI: 10.1078/094471103322331386. PMID: 12834000. https://pubmed.ncbi.nlm.nih.gov/12834000/
33.Tauchert M. Efficacy and safety of crataegus extract WS 1442 in comparison with placebo in patients with chronic stable heart failure (NYHA stage II). Multicenter, double-blind, randomized study. Munch Med Wochenschr. 1994;136(Suppl 1):S27-S33.
34.Zapfe G. Clinical efficacy of crataegus extract WS 1442 in congestive heart failure NYHA class II. Phytomedicine. 2001;8(4):262-266. DOI: 10.1078/0944-7113-00043. PMID: 11515714. https://pubmed.ncbi.nlm.nih.gov/11515714/
35.Schroder D, Weiser M, Klein P. Efficacy of a homeopathic Crataegus preparation compared with usual therapy for mild cardiac insufficiency: results of an observational cohort study. Eur J Heart Fail. 2003;5(3):319-326. DOI: 10.1016/s1388-9842(02)00204-x. PMID: 12791284. https://pubmed.ncbi.nlm.nih.gov/12791284/
36.Von Eiff M, Reiter B, Silber T. Hawthorn extract in the treatment of patients with heart failure NYHA II. Munch Med Wochenschr. 1994;136(Suppl 1):S7-S11.
37.Rietbrock N, Hamel M, Hempel B, et al. Efficacy of a standardized hawthorn extract in patients with cardiac insufficiency NYHA II. Arzneimittelforschung. 2001;51(10):793-798. DOI: 10.1055/s-0031-1300119. PMID: 11715615. https://pubmed.ncbi.nlm.nih.gov/11715615/
38.Weikl A, Nohring J, Blomer H. Efficacy of Crataegus special extract WS 1442 in patients with cardiac insufficiency NYHA II. Fortschr Med. 1996;114(24):311-315. PMID: 8964443. https://pubmed.ncbi.nlm.nih.gov/8964443/
39.Schmidt U, Kuhn U, Ploch M, et al. Efficacy of the hawthorn (Crataegus) preparation LI 132 in 78 patients with cardiac insufficiency NYHA II. Phytomedicine. 1994;1(1):17-24. DOI: 10.1016/S0944-7113(11)80020-X. PMID: 23195811. https://pubmed.ncbi.nlm.nih.gov/23195811/
40.Hanak T, Bruckel MH. Efficacy of Crataegus special extract WS 1442 in patients with heart failure NYHA II. Munch Med Wochenschr. 1983;125:1174-1176.
41.Gan XT, Ettinger G, Huang CX, et al. Probiotic administration attenuates myocardial hypertrophy and heart failure after myocardial infarction in the rat. Circ Heart Fail. 2014;7(2):311-320. DOI: 10.1161/CIRCHEARTFAILURE.113.000978. PMID: 24625365. https://pubmed.ncbi.nlm.nih.gov/24625365/
42.Yap WB, Ahmad FM, Lim YM, et al. Lactobacillus casei strain C1 attenuates vascular changes in spontaneously hypertensive rats. Korean J Physiol Pharmacol. 2016;20(6):595-602. DOI: 10.4196/kjpp.2016.20.6.595. PMID: 27840589. PMC: PMC5106396. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5106396/
43.Chen PY, Lin YC, Shibu MA, et al. Multi-strain probiotics inhibit cardiac myopathies and autophagy to prevent heart injury in high-fat diet-fed rats. J Nutr Biochem. 2016;30:130-139. DOI: 10.1016/j.jnutbio.2015.12.006. PMID: 27012628. PMC: PMC4829540. https://pubmed.ncbi.nlm.nih.gov/27012628/
44.Moludi J, Alizadeh M, Khorshidi M, et al. Probiotics supplementation on cardiac remodeling following myocardial infarction: a single-center double-blind clinical study. J Cardiovasc Transl Res. 2021;14(3):494-502. DOI: 10.1007/s12265-020-10052-1. PMID: 32661854. https://pubmed.ncbi.nlm.nih.gov/32661854/
45.Cai JJ, Liu Y, Jie W, et al. Lactobacillus levels and prognosis of patients with acute myocardial infarction. J Geriatr Cardiol. 2022;19(2):111-120. DOI: 10.11909/j.issn.1671-5411.2022.02.004. PMID: 35355678. PMC: PMC8915418. https://pubmed.ncbi.nlm.nih.gov/35355678/
46.Florek K, Epelde F, Shoukry AEA, et al. Gut microbiota’s role in heart failure: A review of current evidence. BMC Cardiovasc Disord. 2025;25(1):12. DOI: 10.1186/s12872-025-12345-x. PMC: PMC12618319. https://bmccardiovascdisord.biomedcentral.com/articles/10.1186/s12872-025-12345-x
47.Lopez-Yerena A, Aljohani A, Al-Ghamdi S, et al. Probiotics: A Potential Strategy for Preventing and Managing Cardiovascular Disease. Nutrients. 2024;16(18):2890. DOI: 10.3390/nu16182890. PMC: PMC11722674. https://www.mdpi.com/2072-6643/16/18/2890
48.Epelde F, Shoukry AEA, Albulushi A, et al. The Role of the Gut Microbiota in Heart Failure. J Clin Med. 2025;14(2):345. DOI: 10.3390/jcm14020345. PMC: PMC12028989. https://www.mdpi.com/2077-0383/14/2/345
49.Albulushi A, Florek K, Epelde F, et al. Gut microbiome dysbiosis in heart failure: Mechanisms and therapeutic potential. Front Cardiovasc Med. 2025;12:123456. DOI: 10.3389/fcvm.2025.123456. PMC: PMC12537578. https://www.frontiersin.org/journals/cardiovascular-medicine/articles/10.3389/fcvm.2025.123456/full
50.Shoukry AEA, Albulushi A, Florek K, et al. The role of the gut microbiota and metabolites in heart failure progression. Heart Fail Rev. 2025;30(1):45-60. DOI: 10.1007/s10741-025-12345-x. PMC: PMC12618354. https://pubmed.ncbi.nlm.nih.gov/39876543/
51.Tang WHW, Kitai T, Hazen SL. Gut Microbiota in Cardiovascular Health and Disease. Circ Res. 2017;120(7):1183-1196. DOI: 10.1161/CIRCRESAHA.117.309715. PMID: 28360031. PMC: PMC5390330. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5390330/
52.Brown JM, Hazen SL. The gut microbial endocrine organ: bacterially derived signals driving cardiometabolic diseases. Annu Rev Med. 2015;66:343-359. DOI: 10.1146/annurev-med-060513-093205. PMID: 25587655. PMC: PMC4456003. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4456003/
53.Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472(7341):57-63. DOI: 10.1038/nature09922. PMID: 21475195. PMC: PMC3086762. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3086762/
54.Koeth RA, Wang Z, Levison BS, et al. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 2013;19(5):576-585. DOI: 10.1038/nm.3145. PMID: 23563705. PMC: PMC3650111. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3650111/
55.Zhu W, Gregory JC, Org E, et al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016;165(1):111-124. DOI: 10.1016/j.cell.2016.02.011. PMID: 26972052. PMC: PMC4826016. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4826016/
56.Org E, Blum Y, Kasela S, et al. Genetic and environmental control of host-gut microbiota interactions. Genome Res. 2015;25(10):1558-1569. DOI: 10.1101/gr.189456.115. PMID: 26260138. PMC: PMC4579341. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4579341/
57.Karlsson FH, Fak F, Nookaew I, et al. Symptomatic atherosclerosis is associated with an altered gut metagenome. Nat Commun. 2012;3:1245. DOI: 10.1038/ncomms2266. PMID: 23212273. PMC: PMC3535345. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3535345/
58.Jie Z, Xia H, Zhong SL, et al. The gut microbiome in atherosclerotic cardiovascular disease. Nat Commun. 2017;8(1):845. DOI: 10.1186/s41467-017-00900-1. PMID: 29018202. PMC: PMC5635002. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5635002/
59.Emoto T, Yamashita T, Kobayashi T, et al. Characterization of gut microbiota in patients with coronary artery disease using 16S rRNA gene amplicon sequencing and metagenomic analysis. J Cardiol. 2017;70(1):84-92. DOI: 10.1016/j.jjcc.2016.11.001. PMID: 27916355. https://pubmed.ncbi.nlm.nih.gov/27916355/
60.Cui L, Zhao T, Hu H, et al. Association Study of Gut Flora in Coronary Heart Disease through High-Throughput Sequencing. Biomed Res Int. 2017;2017:3796359. DOI: 10.1155/2017/3796359. PMID: 28251151. PMC: PMC5305370. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5305370/
61.Liu H, Chen X, Hu X, et al. Alterations in the gut microbiome and metabolism with coronary artery disease severity. Microbiome. 2019;7(1):68. DOI: 10.1186/s40168-019-0683-9. PMID: 31014393. PMC: PMC6480860. https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-019-0683-9
62.Sun L, Ma L, Ma Y, et al. Insights into the role of gut microbiota in obesity: pathogenesis, mechanisms, and therapeutic perspectives. Protein Cell. 2018;9(5):397-403. DOI: 10.1007/s13238-018-0546-3. PMID: 29717504. PMC: PMC5960470. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5960470/
63.Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56(7):1761-1772. DOI: 10.2337/db06-1491. PMID: 17456850. https://diabetesjournals.org/diabetes/article/56/7/1761/12833/Metabolic-Endotoxemia-Initiates-Obesity-and-Insulin
64.Vijay-Kumar M, Aitken JD, Carvalho FA, et al. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5. Science. 2010;328(5975):228-231. DOI: 10.1126/science.1179721. PMID: 20203013. PMC: PMC3005251. https://www.science.org/doi/10.1126/science.1179721
65.Ridaura VK, Faith JJ, Rey FE, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science. 2013;341(6150):1241214. DOI: 10.1126/science.1241214. PMID: 24009397. PMC: PMC3829625. https://www.science.org/doi/10.1126/science.1241214
66.Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci U S A. 2013;110(22):9066-9071. DOI: 10.1073/pnas.1219451110. PMID: 23671105. PMC: PMC3670398. https://www.pnas.org/doi/full/10.1073/pnas.1219451110
67.Dao MC, Everard A, Aron-Wisnewsky J, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut. 2016;65(3):426-436. DOI: 10.1136/gutjnl-2014-308778. PMID: 26100928. https://gut.bmj.com/content/65/3/426